اکسید برلیوم ( به انگلیسی: Beryllium oxide ) یک ترکیب شیمیایی با شناسه پاب کم ۱۴۷۷۵ است. شکل ظاهری این ترکیب، بلورهای شیشه ای بی رنگ است. اکسید برلیوم بالاترین ترین آنتالپی تشکیل به ازای جرم ( تقریباً ۲۴ مگاژول بر کیلوگرم ) را دارد. اکسید بریلیم، که با نام Beryllia شناخته می شود، یک ترکیب شیمیایی با فرمول BeO می باشد. اکسید برلیوم جامد بی رنگ بوده که عایق الکتریکی بسیار عالی می باشد و همچنین هدایت حرارتی این اکسید بالاتر از بسیاری از فلزات و غیر فلزات به جز الماس می باشد. [ ۳] چنانچه اکسید بریلیوم آمورف بوده و رنگ آن سفید می باشد. به دلیل نقطه ذوب بالای بریلیوم از آن به عنوان یک جرم نسوز استفاده می شود. [ ۴] اکسید برلیوم در طبیعت به عنوان ماده معدنی Bromellite شناخته می شود. از لحاظ تاریخی و در علم مواد، اکسید بریلیم Glucina یا اکسید Glucinium نامیده می شد. تشکیل BeO از بریلیم و اکسیژن دارای انرژی تشکیل بر واحد جرم واکنش دهنده های نزدیک به MJ / kg 24 بوده که در بین انرژی های تشکیل اکسیدها بیشترین مقدار می باشد. [ ۵]
اکسید بریلیم را می توان از تکلیس کربنات بریلیوم، دی هیدراته کردن هیدروکسید بریلیوم یا اشتعال بریلیوم فلزی به شرح واکنش های ذیل تهیه نمود:[ ۶] BeCO3 → BeO + CO2 Be ( OH ) 2 → BeO + H2O 2 Be + O2 → 2 BeO
اشتعال بریلیوم در هوا مخلوطی از BeO و Be3N2 را تولید می کند. [ ۷] اکسید بریلیم بر خلاف اکسیدهای تشکیل شده توسط عناصر ۲ گروه فلزات قلیایی خاکی، آمفوتر می باشد. اکسید بریلیم تشکیل شده در دماهای بالا ( بالاتر از ۸۰۰ درجه سانتیگراد ) خنثی بوده، اما به راحتی در محیط آبی آمونیوم بیفلورید داغ ( NH4HF2 ) ، اسید سولفوریک گرم ( H2SO4 ) یا سولفات آمونیوم ( ( NH4 ) 2SO4 ) حل می شود.
اکسید بریلیم یک ترکیب فوق العاده از خواص فیزیکی و شیمیایی را دارا می باشد. به استثنای واکنش آن با بخار آب در دمای ۱۰۰۰ درجه سانتیگراد، اکسید بریلیم بسیار پایدار بوده و در برابر محیط نمکی و احیای کربن در دمای بالا مقاوم می باشد. [ ۸] خواص فیزیکی و شیمیایی اکسید بریلیم به شرح ذیل می باشد:
• هدایت حرارتی اکسید بریلیم در درمای زیر ۳۰۰ درجه سانتیگراد در مقایسه با سایر سرامیک بالا می باشد بطوری که هدایت حرارتی اکسید بریلیم در دمای اتاق حدود W. m - 1K - 1 265 و هدایت حرارتی آلومینا حدود W. m - 1K - 125 است. [ ۸]
• مقاومت الکتریکی اکسید بریلیم بالا بوده بطوری که به عنوان یک عایق الکتریکی استفاده می شود.
• مقاومت مکانیکی اکسید بریلیم به طور معمول کمتر از آلومینا بوده، اما در حین فرایند ساخت می تواند به استحکام مورد نظر دست پیدا کند.
• مقاومت به شوک حرارتی اکسید بریلیم به دلیل هدایت حرارتی بالای آن زیاد می باشد.
• چگالی اکسید بریلیم حدود kg. m - 3 3010 بوده که از چگالی اکسید آلومینیوم حدود kg. m - 3 3970 کمتر می باشد.
• انبساط حرارتی اکسید بریلیم مشابه سایر اکسیدها می باشد.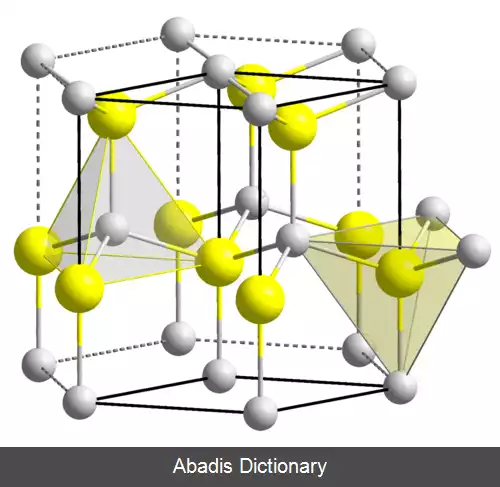
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفاکسید بریلیم را می توان از تکلیس کربنات بریلیوم، دی هیدراته کردن هیدروکسید بریلیوم یا اشتعال بریلیوم فلزی به شرح واکنش های ذیل تهیه نمود:[ ۶] BeCO3 → BeO + CO2 Be ( OH ) 2 → BeO + H2O 2 Be + O2 → 2 BeO
اشتعال بریلیوم در هوا مخلوطی از BeO و Be3N2 را تولید می کند. [ ۷] اکسید بریلیم بر خلاف اکسیدهای تشکیل شده توسط عناصر ۲ گروه فلزات قلیایی خاکی، آمفوتر می باشد. اکسید بریلیم تشکیل شده در دماهای بالا ( بالاتر از ۸۰۰ درجه سانتیگراد ) خنثی بوده، اما به راحتی در محیط آبی آمونیوم بیفلورید داغ ( NH4HF2 ) ، اسید سولفوریک گرم ( H2SO4 ) یا سولفات آمونیوم ( ( NH4 ) 2SO4 ) حل می شود.
اکسید بریلیم یک ترکیب فوق العاده از خواص فیزیکی و شیمیایی را دارا می باشد. به استثنای واکنش آن با بخار آب در دمای ۱۰۰۰ درجه سانتیگراد، اکسید بریلیم بسیار پایدار بوده و در برابر محیط نمکی و احیای کربن در دمای بالا مقاوم می باشد. [ ۸] خواص فیزیکی و شیمیایی اکسید بریلیم به شرح ذیل می باشد:
• هدایت حرارتی اکسید بریلیم در درمای زیر ۳۰۰ درجه سانتیگراد در مقایسه با سایر سرامیک بالا می باشد بطوری که هدایت حرارتی اکسید بریلیم در دمای اتاق حدود W. m - 1K - 1 265 و هدایت حرارتی آلومینا حدود W. m - 1K - 125 است. [ ۸]
• مقاومت الکتریکی اکسید بریلیم بالا بوده بطوری که به عنوان یک عایق الکتریکی استفاده می شود.
• مقاومت مکانیکی اکسید بریلیم به طور معمول کمتر از آلومینا بوده، اما در حین فرایند ساخت می تواند به استحکام مورد نظر دست پیدا کند.
• مقاومت به شوک حرارتی اکسید بریلیم به دلیل هدایت حرارتی بالای آن زیاد می باشد.
• چگالی اکسید بریلیم حدود kg. m - 3 3010 بوده که از چگالی اکسید آلومینیوم حدود kg. m - 3 3970 کمتر می باشد.
• انبساط حرارتی اکسید بریلیم مشابه سایر اکسیدها می باشد.

wiki: بریلیم اکسید
