بار قراردادی
فرهنگستان زبان و ادب
دانشنامه عمومی
در شیمی، بار قراردادی یا FC ( به انگلیسی: Formal Charge ) به بار نسبت داده شده به یک اتم در یک مولکول یا یون، با این فرض که الکترون در یک پیوند شیمیایی میان اتم ها به طور یکسان به اشتراک گذاشته شده باشد البته بدون در نظر گرفتن الکترونگاتیوی اتم ها. [ ۱]
بار قراردادی هر اتم در یک مولکول را می توان با معادله زیر محاسبه کرد:
که در آن V تعداد الکترون های لایه ظرفیت ( والانس ) اتم، N تعداد الکترونهای ناپیوندی اتم و B تعداد الکترونهای پیوندی آن می باشد. در تعیین ساختار لوویس درست ( یا ساختار غالب رزونانس ) برای یک مولکول، ساختار به گونه ای انتخاب می شود که بار قراردادی بر روی هر یک از اتم ها به حداقل رسیده باشد.
در ساختارهای رزونانسی هیچگاه نباید دو اتم مجاور دارای بار یکسان باشند. ( مثلاً {+۱ و +۱ }یا{ - ۱ و - ۱ }یا. . . ) پس اگر در ساختاری این اتفاق افتاد آن ساختار یا غلط است یا اینکه به ندرت در طبیعت یافت خواهد شد.
• در اکسی اسیدها هر چه بار قرار دادی اتم مرکزی بیشتر باشد آن اسید قوی تر است.
• اتم کربن در متان: FC = 4 - 0 - ( 8÷2 ) = ۰
• NO۲ اتم نیتروژن در: FC = 5 - 2 - ( 6÷2 ) = ۰
• NO۲ اتم اکسیژن با پیوند دوگانه در: FC = 6 - 4 - ( 4÷2 ) = ۰
• NO۳ - اتم نیتروژن در یون نیترات: FC = 5 - 0 - ( 8÷2 ) = +۱
باید توجه داشته که جمع جبری تک تک بار قراردادی اتم ها برابر با بار کلی مولکول خواهد بود و بر عکس. [ ۲]
برای مثال: می دانیم مولکول اوزن ( O۳ ) خنثی است از همین رو پیش بینی می کنیم که جمع جبری بار قراردادی تک تک اکسیژن ها باید صفر شود.
و در مثالی دیگر: می دانیم جمع جبری بار قراردادی تک تک اکسیژن ها و نیتروژن در یون نیترات برابر ( - ۱ ) است پس نتیجه می گیریم بار کلی یون برابر ( - ۱ ) است.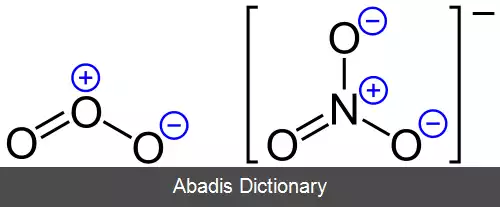


این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفبار قراردادی هر اتم در یک مولکول را می توان با معادله زیر محاسبه کرد:
که در آن V تعداد الکترون های لایه ظرفیت ( والانس ) اتم، N تعداد الکترونهای ناپیوندی اتم و B تعداد الکترونهای پیوندی آن می باشد. در تعیین ساختار لوویس درست ( یا ساختار غالب رزونانس ) برای یک مولکول، ساختار به گونه ای انتخاب می شود که بار قراردادی بر روی هر یک از اتم ها به حداقل رسیده باشد.
در ساختارهای رزونانسی هیچگاه نباید دو اتم مجاور دارای بار یکسان باشند. ( مثلاً {+۱ و +۱ }یا{ - ۱ و - ۱ }یا. . . ) پس اگر در ساختاری این اتفاق افتاد آن ساختار یا غلط است یا اینکه به ندرت در طبیعت یافت خواهد شد.
• در اکسی اسیدها هر چه بار قرار دادی اتم مرکزی بیشتر باشد آن اسید قوی تر است.
• اتم کربن در متان: FC = 4 - 0 - ( 8÷2 ) = ۰
• NO۲ اتم نیتروژن در: FC = 5 - 2 - ( 6÷2 ) = ۰
• NO۲ اتم اکسیژن با پیوند دوگانه در: FC = 6 - 4 - ( 4÷2 ) = ۰
• NO۳ - اتم نیتروژن در یون نیترات: FC = 5 - 0 - ( 8÷2 ) = +۱
باید توجه داشته که جمع جبری تک تک بار قراردادی اتم ها برابر با بار کلی مولکول خواهد بود و بر عکس. [ ۲]
برای مثال: می دانیم مولکول اوزن ( O۳ ) خنثی است از همین رو پیش بینی می کنیم که جمع جبری بار قراردادی تک تک اکسیژن ها باید صفر شود.
و در مثالی دیگر: می دانیم جمع جبری بار قراردادی تک تک اکسیژن ها و نیتروژن در یون نیترات برابر ( - ۱ ) است پس نتیجه می گیریم بار کلی یون برابر ( - ۱ ) است.



wiki: بار قراردادی
پیشنهاد کاربران
پیشنهادی ثبت نشده است. شما اولین نفر باشید
