اپی ژنتیک سرطان مطالعه تغییرات اپی ژنتیکی در دی ان ای سلول های سرطانی و تغییرات برگشت پذیر کروماتین و تأثیر گسترده و عمیق آن ها بر تنظیم ژن است. این تغییرات شامل متیلاسیون DNA و پروتئین های هیستونی ( نوکلئوزوم ها ) ، استیلاسیون، فسفوریلاسیون و ubiquitylation و همچنین بازسازی کروماتین می شود. بسیاری از بیماری ها، مانند سرطان ها و اختلالات نورودژنراتیو، اغلب با تغییرات اپی ژنتیک مرتبط هستند. متیلاسیون DNA منجر به بیماری می شود. [ ۲]
epimutations، همراه با تغییرات ژنتیکی وسیع، نقش مهمی در شروع و پیشرفت سرطان دارند. Epimutations می تواندباعث خاموش شدن ژن های سرکوبگر تومور به طور مستقل شود. علاوه بر غیرفعال کردن سرکوبگرهای تومور، اپی موتاسیون همچنین می تواند با فعال کردن انکوژن ها باعث ایجاد تومور شود. اتفاقاتی که منجر به شروع این ناهنجاری های اپی ژنتیکی می شوند. با این وجود، از طرفی تغییرات اپی ژنتیکی، مانند جهش های ژنتیکی، از نظر میتوزی قابل وراثت هستند، برای جمعیت سلول های سرطانی که به سرعت در حال رشد هستند انتخاب می شوند و مزایا رشدی را به سلول های تومور است که منجر به رشد کنترل نشده آن ها می شود. [ ۳]
آغاز سرطان با تغییرات زیاد، در متیلاسیون DNA همراه است که اولین تغییرات اپی ژنتیکی شناسایی شده در سرطان می باشد. هیپومتیلاسیون DNA نقش مهمی در تومورزایی دارد و توالی های ژنومی مختلف از جمله عناصر تکراری، رتروترانسپوزون ها، پروموترهای ضعیف CpG، اینترون ها و بیان ژن ها را تحت تأثیر قرار می دهد. هیپومتیلاسیون توالی های تکراری با ترویج بازآرایی های کروموزومی، بی ثباتی ژنومی را افزایش می دهد. فعال سازی و انتقال رتروترانسپوزون ها به سایر نواحی ژنومی نیز می تواند به دلیل هیپومتیلاسیون رخ دهد که باعث افزایش بیشتر ناپایداری ژنومی می شود. نقص ایمنی، ناپایداری ناحیه سانترومر و سندرم ناهنجاری ها که با جهش در آنزیم DNMT3B و هیپومتیلاسیون متعاقب آن مشخص می شود، القای بی ثباتی ژنومی توسط هیپومتیلاسیون ایجاد می شود. [ ۴]
در تومور، غیاب IGF2 ناشی از هیپومتیلاسیون، یک فاکتور رشد اتوکرین مهم، باعث به بیان بی آللی پاتولوژیک آن می شود. هیپومتیلاسیون DNA از طریق فعال شدن نابجای ژن ها و مناطق غیر کدکننده از طریق مکانیسم های مختلف به توسعه و پیشرفت سرطان کمک می کند. بر خلاف هیپومتیلاسیون، که بی ثباتی ژنومی را افزایش می دهد و پروتوآنکوژن ها را فعال می کند، هایپرمتیلاسیون با غیرفعال کردن ژن های سرکوبگر تومور به تومورزایی کمک می کند. [ ۵]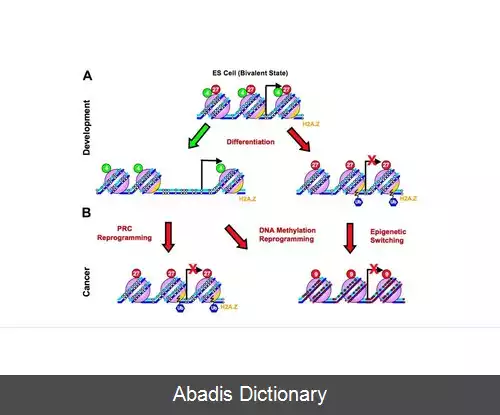
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفepimutations، همراه با تغییرات ژنتیکی وسیع، نقش مهمی در شروع و پیشرفت سرطان دارند. Epimutations می تواندباعث خاموش شدن ژن های سرکوبگر تومور به طور مستقل شود. علاوه بر غیرفعال کردن سرکوبگرهای تومور، اپی موتاسیون همچنین می تواند با فعال کردن انکوژن ها باعث ایجاد تومور شود. اتفاقاتی که منجر به شروع این ناهنجاری های اپی ژنتیکی می شوند. با این وجود، از طرفی تغییرات اپی ژنتیکی، مانند جهش های ژنتیکی، از نظر میتوزی قابل وراثت هستند، برای جمعیت سلول های سرطانی که به سرعت در حال رشد هستند انتخاب می شوند و مزایا رشدی را به سلول های تومور است که منجر به رشد کنترل نشده آن ها می شود. [ ۳]
آغاز سرطان با تغییرات زیاد، در متیلاسیون DNA همراه است که اولین تغییرات اپی ژنتیکی شناسایی شده در سرطان می باشد. هیپومتیلاسیون DNA نقش مهمی در تومورزایی دارد و توالی های ژنومی مختلف از جمله عناصر تکراری، رتروترانسپوزون ها، پروموترهای ضعیف CpG، اینترون ها و بیان ژن ها را تحت تأثیر قرار می دهد. هیپومتیلاسیون توالی های تکراری با ترویج بازآرایی های کروموزومی، بی ثباتی ژنومی را افزایش می دهد. فعال سازی و انتقال رتروترانسپوزون ها به سایر نواحی ژنومی نیز می تواند به دلیل هیپومتیلاسیون رخ دهد که باعث افزایش بیشتر ناپایداری ژنومی می شود. نقص ایمنی، ناپایداری ناحیه سانترومر و سندرم ناهنجاری ها که با جهش در آنزیم DNMT3B و هیپومتیلاسیون متعاقب آن مشخص می شود، القای بی ثباتی ژنومی توسط هیپومتیلاسیون ایجاد می شود. [ ۴]
در تومور، غیاب IGF2 ناشی از هیپومتیلاسیون، یک فاکتور رشد اتوکرین مهم، باعث به بیان بی آللی پاتولوژیک آن می شود. هیپومتیلاسیون DNA از طریق فعال شدن نابجای ژن ها و مناطق غیر کدکننده از طریق مکانیسم های مختلف به توسعه و پیشرفت سرطان کمک می کند. بر خلاف هیپومتیلاسیون، که بی ثباتی ژنومی را افزایش می دهد و پروتوآنکوژن ها را فعال می کند، هایپرمتیلاسیون با غیرفعال کردن ژن های سرکوبگر تومور به تومورزایی کمک می کند. [ ۵]

wiki: اپی ژنتیک سرطان
