استحاله هم دما یا گذار فاز هم دما ( به انگلیسی: Isothermal Phase Transition ) مرحله ای از تغییر فاز یک ماده است. در این مرحله از فرآیند تغییر فاز، دمای ماده در اثر انتقال انرژی گرمایی ( گرفتن گرما از سیستم یا دادن انرژی به آن ) تغییر نمی کند.
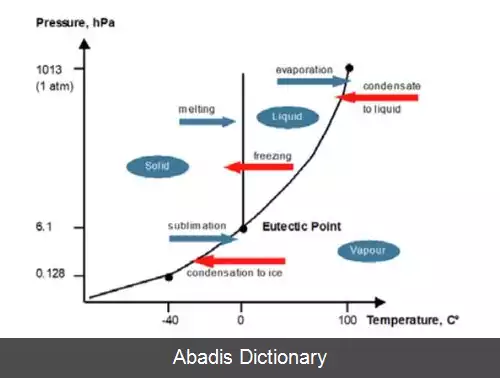
برای تغییر فاز یک ماده ابتدا با انتقال گرما ( دادن یا گرفتن انرژی ) دمای ماده را به دمای مورد نیاز برای تغییر فاز آن می رسانیم. مقدار این انرژی متناسب با ظرفیت گرمایی ویژه ی ماده و جرم آن تعیین می شود. ( Q=mcΔT ) بعد از رسیدن ماده به این دما، ادامه ی انتقال انرژی صرف تغییر فاز ماده می شود؛ در حالی که دمای آن ثابت می ماند. مقدار این انرژی نیز متناسب با جرم ماده و گرمای نهان آن مشخص می شود. ( Q=mL ) پس از صرف این میزان انرژی، حالت ماده تغییر می کند. بعد از رسیدن به این مرحله با ادامه ی انتقال انرژی می توان دمای ماده را تغییر داد.
به عنوان مثال یخ با دمای 20 - درجه ی سانتی گراد را در نظر بگیرید. ابتدا با دادن گرما به یخ، دمای آن را به 0 درجه می رسانیم. ( دمای ذوب یخ ) سپس با ادامه ی دادن گرما به یخ، حالت یخ از جامد شروع به تغیر به مایع می کند اما همچنان دمای آن ثابت است تا جایی که همه ی یخ تغییر فاز بدهد. پس از آن دوباره با دادن انرژی، دمای آب مایع را به 100 درجه ی سانتی گراد می رسانیم. ( نقطه جوش آب ) ادامه ی انتقال انرژی باعث تغییر حالت آب مایع به بخار آب ( گاز ) می شود. دقت شود که در این مرحله هم دما ثابت است.
ذوب شدن یخ را در نظر بگیرید. با دادن گرما به یخ، به آن انرژی منتقل می کنیم که باعث افزایش انرژی جنبشی مولکول های آن می شود. از آنحایی که دما به صورت متوسط انرژی جنبشی ذرات یک سیستم تعریف می شود، پس باید دمای سیستم افزایش پیدا کند. اما در استحاله ی هم دما، این انرژی به جای افزایش دما، صرف از بین بردن نیروهای بین مولکولی ماده می شود. به این شکل که با افزایش انرژی جنبشی مولکول ها، ارتعاش آنها بیشتر شده و فاصله ی آنها هم افزایش می یابد. در نتیجه نیروهای بین مولکولی ضعیف شده و با ادامه ی انتقال انرژی، از بین می روند. در واقع انرژی درونی ماده تغییر می کند و به جای تاثیر بر دمای ماده، بر فاز ماده اثر می گذارد.
در تبخیر نیز پس از رسیدن آب به دمای 100درجه، با گرما دادن به آب، جنبش مولکول ها و انرژی آنها افزایش می یابد و از انرژی پیوندها بیشتر می شود. پس می توانند بر این پیوندها غلبه کنند و آنها را بشکنند. به این ترتیب وابستگی ای به سایر مولکول های آب نخواهند داشت و می توانند آزادانه حرکت کنند. البته بین مولکول های آب در حالت گازی هم نیروهای بین مولکولی وجود دارد اما به مراتب ضعیف تر از حالت مایع است.
این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفبرای تغییر فاز یک ماده ابتدا با انتقال گرما ( دادن یا گرفتن انرژی ) دمای ماده را به دمای مورد نیاز برای تغییر فاز آن می رسانیم. مقدار این انرژی متناسب با ظرفیت گرمایی ویژه ی ماده و جرم آن تعیین می شود. ( Q=mcΔT ) بعد از رسیدن ماده به این دما، ادامه ی انتقال انرژی صرف تغییر فاز ماده می شود؛ در حالی که دمای آن ثابت می ماند. مقدار این انرژی نیز متناسب با جرم ماده و گرمای نهان آن مشخص می شود. ( Q=mL ) پس از صرف این میزان انرژی، حالت ماده تغییر می کند. بعد از رسیدن به این مرحله با ادامه ی انتقال انرژی می توان دمای ماده را تغییر داد.
به عنوان مثال یخ با دمای 20 - درجه ی سانتی گراد را در نظر بگیرید. ابتدا با دادن گرما به یخ، دمای آن را به 0 درجه می رسانیم. ( دمای ذوب یخ ) سپس با ادامه ی دادن گرما به یخ، حالت یخ از جامد شروع به تغیر به مایع می کند اما همچنان دمای آن ثابت است تا جایی که همه ی یخ تغییر فاز بدهد. پس از آن دوباره با دادن انرژی، دمای آب مایع را به 100 درجه ی سانتی گراد می رسانیم. ( نقطه جوش آب ) ادامه ی انتقال انرژی باعث تغییر حالت آب مایع به بخار آب ( گاز ) می شود. دقت شود که در این مرحله هم دما ثابت است.
ذوب شدن یخ را در نظر بگیرید. با دادن گرما به یخ، به آن انرژی منتقل می کنیم که باعث افزایش انرژی جنبشی مولکول های آن می شود. از آنحایی که دما به صورت متوسط انرژی جنبشی ذرات یک سیستم تعریف می شود، پس باید دمای سیستم افزایش پیدا کند. اما در استحاله ی هم دما، این انرژی به جای افزایش دما، صرف از بین بردن نیروهای بین مولکولی ماده می شود. به این شکل که با افزایش انرژی جنبشی مولکول ها، ارتعاش آنها بیشتر شده و فاصله ی آنها هم افزایش می یابد. در نتیجه نیروهای بین مولکولی ضعیف شده و با ادامه ی انتقال انرژی، از بین می روند. در واقع انرژی درونی ماده تغییر می کند و به جای تاثیر بر دمای ماده، بر فاز ماده اثر می گذارد.
در تبخیر نیز پس از رسیدن آب به دمای 100درجه، با گرما دادن به آب، جنبش مولکول ها و انرژی آنها افزایش می یابد و از انرژی پیوندها بیشتر می شود. پس می توانند بر این پیوندها غلبه کنند و آنها را بشکنند. به این ترتیب وابستگی ای به سایر مولکول های آب نخواهند داشت و می توانند آزادانه حرکت کنند. البته بین مولکول های آب در حالت گازی هم نیروهای بین مولکولی وجود دارد اما به مراتب ضعیف تر از حالت مایع است.


wiki: استحاله هم دما
