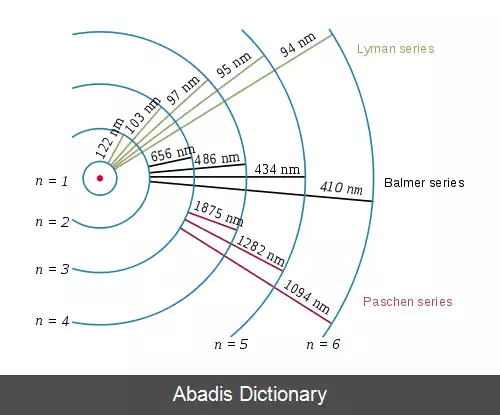
در طیف تابشی اتم هیدروژن چند سری وجود دارد که بر اساس فرمول ریدبرگ بدست می آید. سری های طیفی در اخترشناسی برای بررسی حضور هیدروژن و محاسبه انتقال قرمز کاربرد دارند.
در فیزیک انتشار این امواج به این دلیل است که الکترون ها در مدارهای مانا ( با فاصله بیشتر از هسته ) در اطراف هسته هیدروژن می گردند و هنگامی که از مدار مانا با انرژی بیشتر به مدار با انرژی کمتر ( مدار های پائین تر ) بروند. انرژی مازاد را که فاصله بین این دو مدار است به صورت نوری ، تابش می کنند.
نام گذاری هر انتقال به صورت بیان نام سری و سپس حروف الفبای یونانی است به این ترتیب که از نزدیک ترین مدار اگر به مدار موردنظر رفت آلفا سپس بتا و دیگر حروف یونانی. مثلاً انتقال از ۲ → ۱ «لیمان - آلفا» ( Ly - α ) نامیده می شود و ۷ → ۳ «پاشن - دلتا» ( Pa - δ ) .
میزان انرژی جذب شده یا تابش شده میان الکترونی که در مدار مانا جابجا شود از فرمول ریدبرگ بدست می آید:[ ۱]
که n مدار اولیه است، n′ مدار نهایی است، و R ثابت ریدبرگ. [ ۲]
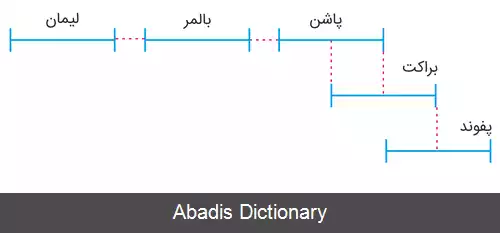
به نام کاشف آن تئودور لیمان نامگذاری شده است و در محدوده فرابنفش قرار دارد.
به افتخار یوهان بالمر نام گذاری شده و دوتای این خطوط در محدوده فرابنفش و بقیه آن در محدوده نور مرئی قرار می گیرد. خطوط مرئی آن در خطوط فرانهوفر نیز وجود دارند
به نام فردریش پاشن هستند و در محدوده فروسرخ قرار می گیرند. [ ۳]
به نام فردریک براکت دانشمند آمریکایی که در سال ۱۹۲۲ این خطوط را مشاهده کرد و در محدوده فروسرخ قرار میگیرند. [ ۴]
در سال ۱۹۲۴ توسط آگست هرمان فوند برای نخستین بار مشاهده شد در محدوده فروسرخ قرار میگیرند. [ ۵]
توسط فیزیک دانان آمریکایی کورتیس همفریس کشف شد در محدوده فروسرخ قرار میگیرند. [ ۶]


این نوشته برگرفته از سایت ویکی پدیا می باشد، اگر نادرست یا توهین آمیز است، لطفا گزارش دهید: گزارش تخلفدر فیزیک انتشار این امواج به این دلیل است که الکترون ها در مدارهای مانا ( با فاصله بیشتر از هسته ) در اطراف هسته هیدروژن می گردند و هنگامی که از مدار مانا با انرژی بیشتر به مدار با انرژی کمتر ( مدار های پائین تر ) بروند. انرژی مازاد را که فاصله بین این دو مدار است به صورت نوری ، تابش می کنند.
نام گذاری هر انتقال به صورت بیان نام سری و سپس حروف الفبای یونانی است به این ترتیب که از نزدیک ترین مدار اگر به مدار موردنظر رفت آلفا سپس بتا و دیگر حروف یونانی. مثلاً انتقال از ۲ → ۱ «لیمان - آلفا» ( Ly - α ) نامیده می شود و ۷ → ۳ «پاشن - دلتا» ( Pa - δ ) .
میزان انرژی جذب شده یا تابش شده میان الکترونی که در مدار مانا جابجا شود از فرمول ریدبرگ بدست می آید:[ ۱]
که n مدار اولیه است، n′ مدار نهایی است، و R ثابت ریدبرگ. [ ۲]
به نام کاشف آن تئودور لیمان نامگذاری شده است و در محدوده فرابنفش قرار دارد.
به افتخار یوهان بالمر نام گذاری شده و دوتای این خطوط در محدوده فرابنفش و بقیه آن در محدوده نور مرئی قرار می گیرد. خطوط مرئی آن در خطوط فرانهوفر نیز وجود دارند
به نام فردریش پاشن هستند و در محدوده فروسرخ قرار می گیرند. [ ۳]
به نام فردریک براکت دانشمند آمریکایی که در سال ۱۹۲۲ این خطوط را مشاهده کرد و در محدوده فروسرخ قرار میگیرند. [ ۴]
در سال ۱۹۲۴ توسط آگست هرمان فوند برای نخستین بار مشاهده شد در محدوده فروسرخ قرار میگیرند. [ ۵]
توسط فیزیک دانان آمریکایی کورتیس همفریس کشف شد در محدوده فروسرخ قرار میگیرند. [ ۶]





wiki: خطوط طیفی هیدروژن
